
30/03/2023 - Nota de premsa
Afegir un pèptid, una molècula formada per diversos aminoàcids, a l'oxaliplatí, una quimioteràpia usada com a tractament del càncer de còlon i recte, evita els efectes secundaris d'aquest tractament a les cèl·lules normals del tumor, entre ells, la possibilitat de desenvolupar resistència a la quimioteràpia
Ho valida un article publicat al Journal of Medicinal Chemistry, liderat per l'Institut Hospital del Mar d'Investigacions Mèdiques i l'Institut de Recerca Biomèdica (IRB Barcelona). Aquest treball és la segona part d'un estudi recent on s'analitzava com l'acumulació de platí a les cèl·lules normals, afavoreix la resistència a aquest tractament a les cèl·lules tumorals de càncer de còlon i recte
Amb aquest nou abordatge, s'evita que les cèl·lules sanes que rodegen el tumor acumulin platí. D'aquesta manera, s'evita que s'hi activin determinats gens, vinculats a la mala resposta al tractament i a la progressió tumoral
Un equip multidisciplinari format per investigadors mèdics i científics de l'Institut Hospital del Mar d'Investigacions Mèdiques (IMIM-Hospital del Mar) i l'Institut de Recerca Biomèdica (IRB Barcelona), ha liderat un estudi, que s'acaba de publicar al Journal of Medicinal Chemistry, en el qual es proposa un abordatge terapèutic per evitar que es generi resistència a la quimioteràpia amb oxaliplatí, un dels tractaments estàndard en el càncer de còlon i recte. El treball, que també ha comptat amb la participació de metges i metgesses dels serveis d'Anatomia Patològica i d'Oncologia Mèdica de l'Hospital del Mar, així com d'investigadors de la Universitat d'Oviedo i del CIBER del Càncer (CIBERONC), és un pas més cap a la personalització de l'abordatge terapèutic del càncer.
Aquest grup d'investigadors ja havia comprovat, en un treball publicat a Nature Communications, com aquest tipus de quimioteràpia s'acumula a les cèl·lules sanes que rodegen el tumor, els fibroblasts. Aquest fet provoca que s'activin una sèrie de gens vinculats a una mala resposta al tractament i a la progressió tumoral, fet que estimula l'entorn tumoral i ajuda a les cèl·lules tumorals que han sobreviscut a la quimioteràpia a proliferar de nou. Per evitar-ho, els autors del nou estudi proposen afegir un pèptid específic (cell-penetrating peptide, en anglès) a l'oxaliplatí.
"La conversió d'un tractament sistèmic, que afecta els òrgans sans i al microambient tumoral, afegint-hi aquest pèptid, ens permet transformar-lo en quelcom més específic, una teràpia dirigida, acostant-nos així a la medicina personalitzada", apunta el Dr. Alexandre Calon, investigador de l'IMIM-Hospital del Mar i que ha coliderat el treball. Les conclusions es basen en l'anàlisi de mostres de tumors de prop de 200 pacients amb càncer de còlon i recte. Així mateix, s'han analitzat mostres de tumors de ratolins i de pacients tractats ex vivo per comprovar que afegir un determinat pèptid a l'oxaliplatí, disminuïa els efectes adversos d'aquesta quimioteràpia a les cèl·lules normals del tumor fet pel qual podria reduir la resistència a aquest tractament.
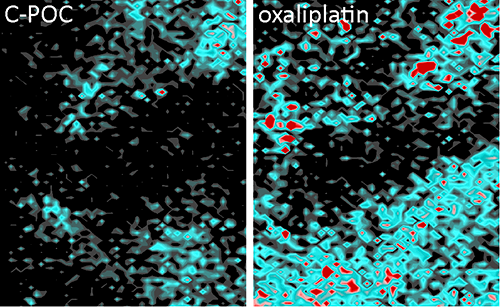
Acumulació de platí després del tractament
Els resultats indiquen que l'acumulació de platí al microentorn dels tumors dels ratolins tractats amb aquest nou abordatge cau de forma dràstica i és fins a 3,5 vegades més baixa. "Hem vist que la càrrega de quimioteràpia es redueix en els fibroblasts, tractats amb el nou compost respecte als tractats amb oxaliplatí, el que redueix la possibilitat d'induir resistència al tractament a les cèl·lules tumorals", explica el Dr. Calon. D'aqui la importància de tenir en compte que "el càncer no és només les cèl·lules tumorals, sinó també un microambient compost pels vasos sanguinis, els fibroblasts i cèl·lules del sistema immunitari, que estan allà per estructurar el tumor".
Els investigadors també van identificar que el nou fàrmac no només s'acumulava menys a l'entorn del tumor dels ratolins, sinó també als òrgans que normalment es veuen més afectats per la quimioteràpia, com són el mateix còlon, els ronyons i el fetge. En aquest sentit, la Dra. Jenniffer Linares, investigadora del mateix grup i primera autora de l'estudi, explica que "el tractament clàssic té una sèrie d'efectes secundaris en el pacient, que pensem que podrien reduir-se amb el nou fàrmac, en acumular-se menys platí als teixits sans".
"Aquest estudi és un primer pas essencial per a un futur desenvolupament en la clínica de tractaments que permetin menys efectes secundaris i major eficàcia en pacients amb càncer de còlon i recte, tenint en compte que les cèl·lules normals que formen part dels tumors juguen un paper clau en l'eficàcia dels tractaments", explica la Dra. Clara Montagut, cap de secció de tumors gastrointestinals de l'Hospital del Mar i investigadora del CIBERONC.
Aquests descobriments porten el Dr. Daniele Lo Re, que ha coliderat l'estudi, a apuntar que "modificant químicament l'estructura de l'oxaliplatí podem modular la seva activitat al microambient tumoral sense perdre eficàcia. A partir d'aquí, podem pensar a integrar aquesta aproximació als processos de descobriment de noves drogues, utilitzant els models cel·lulars adequats que permetin validar un nombre més gran de potencials nous fàrmacs tant al tumor com al seu microambient".
El treball ha comptat amb el suport de l'Instituto de Salud Carlos III i de l'Associació Contra el Càncer.
Membres de l’equip investigador
Article de referència
Peptide-Platinum(IV) Conjugation Minimizes the Negative Impact of Current Anticancer Chemotherapy on Nonmalignant Cells. Jenniffer Linares, Monica Varese, Anna Sallent-Aragay, Ana Méndez, Sergio Palomo-Ponce, Mar Iglesias, Eduard Batlle, Jorge Pisonero, Clara Montagut, Ernest Giralt, Daniele Lo Re, and Alexandre Calon. Journal of Medicinal Chemistry Article ASAP DOI: 10.1021/acs.jmedchem.2c01717
Altres articles relacionats
Linares, J., Sallent-Aragay, A., Badia-Ramentol, J. et al. Long-term platinum-based drug accumulation in cancer-associated fibroblasts promotes colorectal cancer progression and resistance to therapy. Nat Commun 14, 746 (2023). https://doi.org/10.1038/s41467-023-36334-1
Servei de Comunicació:
Marta Calsina Freixas(ELIMINAR)
Tel:
(+34) 93 316 06 80
Doctor Aiguader, 88
08226 Barcelona
© Institut Hospital del Mar
d'Investigacions MèdiquesAvís Legal i Política de Privacitat | Política de cookies | Mapa web | Accessibilitat | Adreça / Accessos | Contacte